毛囊干细胞,是很多发友都很熟悉的老朋友了,听说前不久关于它的研究又更新了,今天我们就来了解一下。
9月,德国马克斯·普朗克老龄生物学研究所的研究人员在 Cell Metabolism 杂志发表题为:GlutamineMetabolism Controls Stem Cell Fate Reversibility and Long-Term Maintenance inthe Hair Follicle(谷氨酰胺代谢调控毛囊干细胞的命运可逆性和长期维持)的研究论文。

这项研究发现了一种防止脱发的新机制:对头发再生至关重要的毛囊干细胞,可以通过改变它们的代谢状态来应对组织中的低氧浓度,从而延长它们的寿命。
简单来说就是,通过改变毛囊干细胞的代谢状态来留住头发、扭转脱发命运。
在研究之前,我们先来了解一下,毛囊干细胞是什么,以及它对头发有何作用。
毛囊干细胞是什么?
毛囊干细胞(hair follicle stem cells,HFSC)是毛囊中的原始细胞,它的定位目前普遍认为是毛囊上段的隆突区,人的头发和体毛都是从毛囊中生长出来的。
毛囊干细胞(HFSCs)通过自我更新,分化以及去分化来维持其自身动态平衡,调控毛发再生以及皮肤伤口愈合等重要生理过程。
负责生发的毛囊干细胞通常处在休眠状态,但会在新一轮生发周期中迅速活化分裂。当相邻部位受到损伤后,毛囊干细胞可从原定位的隆突区中迁出并修复损伤部位。
但研究人员一直对具体机制知之甚少,所以Sara Wickstr?m团队长期致力于研究HFSCs的更新以及分化,特别是干细胞如何感知外界物理机械作用,以及后者对干细胞的调控机制。
so,这就是这篇研究的背景了,下面我们正式开始。
毛囊干细胞是完美模型系统
本研究的首席科学家Christine Kim博士表示:“毛囊干细胞是一类功能已被清楚了解且可被明确识别的干细胞,同时也是研究这个重要问题的完美模型系统。";
为了解是什么使得毛囊干细胞(HFSCs)在功能上不同于它们分化的子细胞,研究小组探究了这两者的转录和代谢情况。有趣的是,他们的研究结果表明毛囊干细胞与其子细胞具有不同的代谢特征。
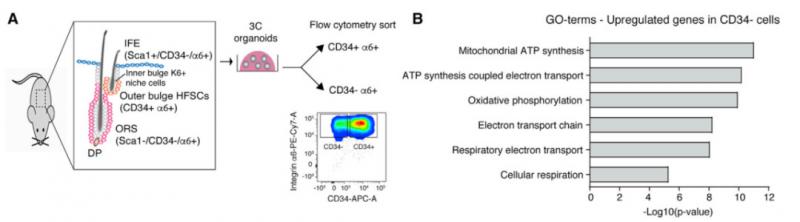
▲HFSCs和早期祖细胞具有不同的代谢特征
Kim博士等通过进一步分析预测,代谢主调节因子mTOR通路的重要分子Rictor将参与到这个过程中,而mTOR信号转导通路调节细胞的生长、能量和氧气消耗等过程。
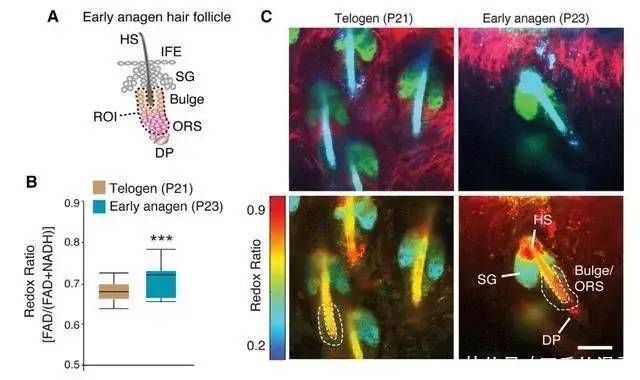
▲进入毛囊生长期,毛囊干细胞氧化增加
在更详细的分析中,研究团队发现,毛囊干细胞的消耗是由于代谢灵活性的丧失——在每一个再生周期的末尾,一根新的毛发被制造出来,与此同时,毛囊干细胞会回到它们特定的位置,并恢复到静止状态。
这种转变是由低氧浓度和Rictor信号触发的。而Rictor的敲除将破坏毛囊干细胞命运逆转的能力,触发了缓慢的、依赖于年龄的毛囊干细胞衰竭和年龄引起的脱发。
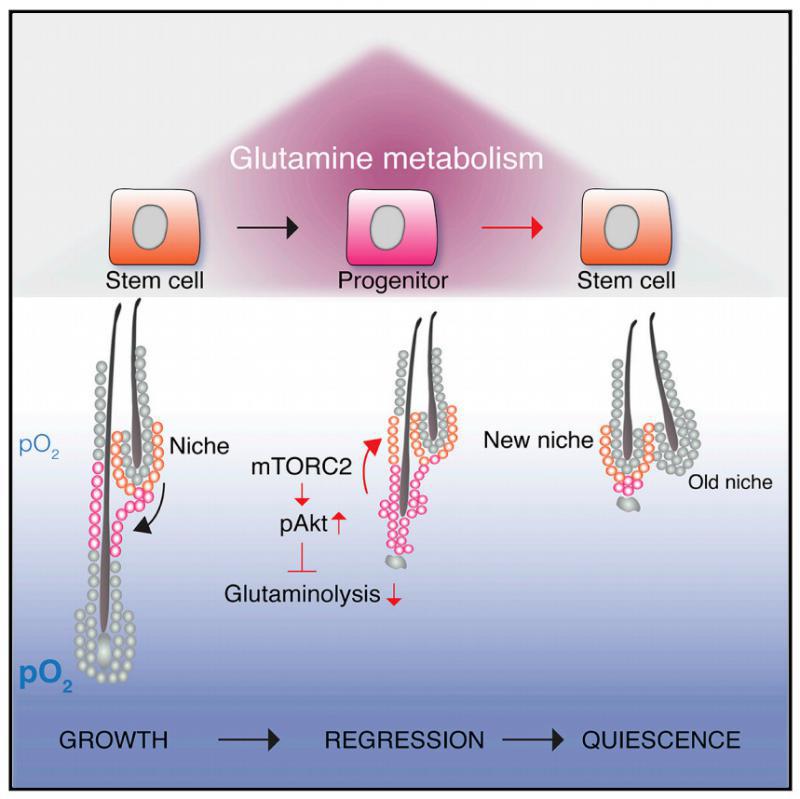
对此,文章的另一位作者XiaoleiDing解释道:“我们研究的关键发现是,所谓的“命运可逆性”需要从谷氨酰胺代谢和细胞呼吸转化为糖酵解。”
小鼠:为实验秃头
为了增强研究发现的说服力,Ding等还构建了Rictor敲除的基因小鼠模型。(小鼠:为实验秃头)
他们观察到缺失Rictor的小鼠显着延迟了毛囊的再生和循环,这表明干细胞调节功能受损。并且,随着年龄的增长,这些老鼠出现了脱发和干细胞数量的减少。
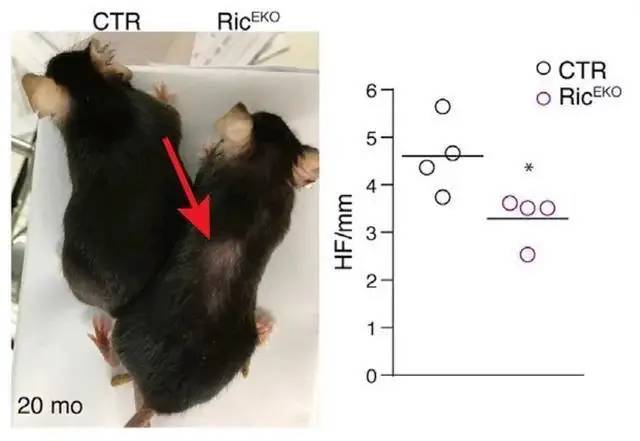
▲基因小鼠模型表现出脱发特征
总的来说,该研究工作表明mTORC2-Akt 信号通过影响谷氨酰胺代谢,进而在毛发再生周期中HFSCs稳态起到重要的调控作用。
最后,文章的通讯作者之一、德国科隆大学的皮肤科医学教授Sabine Eming表示,他们未来的一个主要研究目标是如何将这些临床前发现转化为可能的药物,以防止毛囊老化,从而减少脱发患者的脱发现象。
让他尤其感到兴奋的是,使用谷氨酰胺酶抑制剂能够恢复Rictor缺失小鼠的干细胞功能,证明了修改代谢途径可能是增强组织再生能力的一种强大方式。
对于我们来说,这也确实是一个值得期待的好消息。脱发人的命运从此有了逆转的可能,也许在许多年之后就再也没有人需要经受脱发的烦恼。